활성탄 상식1
1.활성탄이란?
활성탄은 활성탄소(Activated Carbon)라고 말하기도 하며, 흡착성이 강하고 대부분의 구성물질이 탄소질로된 물질이다.
야자각, 목재류, 갈탄, 무연탄, 유연탄등의 탄소질 원료를 태우는 활성화 과정을 통해 분자 크기 정도의 미세세공을 발달시킨 흡착제이며, 흡착성이 강한 분상 또는 입상다공성 물질로 내부에는 1g당 500~1500㎡ 정도의 표면적을 갖고 있다.
최근 참숯, 대나무숯, 야자숯등 우리생활에서 쉽게 접해볼수 있게 되었으며, 화장품 부터 담배, 정수기 등 여러 분야에서 다양하게 사용되고 있다.
이러한 숯(Char)은 탄소질 원료를 탄화만 한 상태로 소량의 세공과 흡착능력을 가지고 있으며, 이 숯을 물리화학적으로 활성화한 것을 활성탄이라고 한다.
2.활성탄의 분류
활성탄은 아래와 같이 형태, 원료, 용도, 활성화 방법에 따라 분류될 수 있다.
① 형태에 의한 분류
| 파쇄상 |
입자크기가 보통 3~200mesh로써 불규칙한 형상 |
| 분말상 |
통상 200mesh 이하의 입도 |
| 성형상 |
조립탄, 규격크기의 형상으로 주로 구형, 원주형 |
| 섬유상 |
ACF라고 말하며 Cloth 상태임 |
② 원료에 의한 분류
| 식물계 |
야자각, 목재, 톱밥, 목탄 등 |
| 석탄계 |
유연탄, 무연탄, 갈탄, 이탄 등 |
| 석유계 |
석유잔사, 황산 슬러지, 오일카본 |
| 기타 |
펄프폐액, 합성수지 폐재, 유기질 폐기물 |

③ 용도에 의한 분류
| 기상용 |
공기 및 Gas 중 선택적 제거 성분의 흡착 |
| 액상용 |
물 및 액상물질 중 선택적 성분의 제거 |
| 촉매용 |
활성탄 특성을 활용한 촉매 및 간접담체로 활용 |
| 기타 |
의약용으로도 정제 후 사용 |
④ 활성화 방법에 의한 분류
| 기체 활성화법 |
각종 산화성가스(수증기, 이산화탄소, 공기 등)에 의해 800~1100℃ 정도의 고온가스활성화 반응으로 부활되고, 흡착성능은 산화성 가스의 화학적 성질과 농도, 반응온도, 부활시간, 원료에 포함되어 있는 양과 종류 등에 의해서 결정되며 크게 회전로와 다단로를 이용 제조된다. |
| 약품 활성화법 |
인산, 황산 등의 산을 사용하여 약품처리하는 부활법으로 제조공정의 복잡성, 장치부식, 2차오염 및 경제성 등으로 주로 가스활성화법인 수증기 부활법이 널리 이용되고 있다. |
3.흡착현상이란?
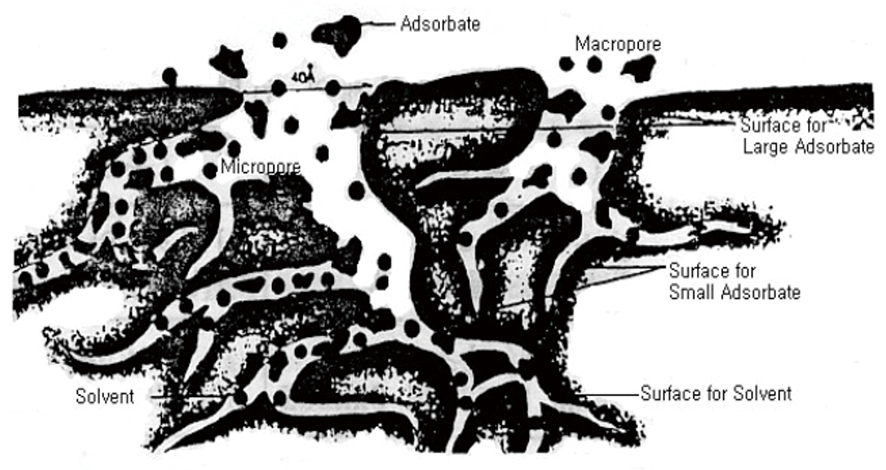
활성탄의 흡착은 흡착제 표면에 피흡착질 분자가 축적되는 것이며, 흡착될 수 있는 물질의 양은 흡착제의 비표면적 크기에 따라 다르다. 활성탄의 세공은 복잡한 그물 망 구조를 나타내며 거대한 내부표면적을 이루고 있는 모세관을 가지고 있다.
① 활성탄 세공 구조 및 세공분포

② 세공 종류별 분류
| 종류 |
크기 |
비표면적(㎡/g) |
| 거대공(macropore) |
1000Å 이상 |
0.5~2.0 |
| 중간공(mesopore) |
20~1000Å |
1~200 |
| 미세공(micropore) |
20Å 이하 |
700~1400 |
③ 활성탄 제조원료별 물성
| 제조원료 |
비표면적(㎡/g) |
세공용적(㎖/g) |
평균세공직경(㎚) |
| 목탄계열(약품부활) |
1,120 |
1.03 |
3.0 |
| 석탄계열 |
1,050 |
0.55 |
1.4 |
| 야자계열 |
1,050 |
0.45 |
0.9 |
| 석탄계열(약품부활) |
1,020 |
1.02 |
3.0 |
④ 흡착메커니즘
흡착은 두 개의 상(相)이 접촉되는 계면에서 이루어지며, 각 상의 밀도가 내부와는 다르다.
예를 들면 용액에서는 고체와 접촉하는 계면부분 또는 공기와 접촉하는 표면 부분에서의 용질의 농도가 액 내부의 용질의 농도와 다르게 되는 현상을 흡착이라 한다. 또한 분자가 부착할 수 있도록 표면을 제공하는 물질을 흡착제라고 하고, 표면에 부착되는 분자를 피흡착물이라고 한다. 흡착제는 다공성(多孔性)으로서 내부표면이 대단히 크고, 흡착성이 좋은 고체이다.
흡착은 용액안에 있는 용해물질을 흡착제의 표면에 모이도록 3단계의 반응으로 이루어진다.
| 1단계 |
피흡착질 분자들이 흡착제(활성탄) 외부 표면으로 이동 (속도느림) |
| 2단계 |
피흡착질이 활성탄의 대세공, 중간세공을 통해 확산 (속도느림) |
| 3단계 |
확산된 피흡착질이 미세공 내부표면과의 결합 또는 미세공에 채워짐 (속도빠름) |
위 단계중 3단계는 빨리 일어나므로 주로 1,2단계에서 흡착이 제한받게 된다.
그러므로 흡착률은 피흡착물의 분자가 용액내에서 이동, 즉 확산하는 율에 의하여 결정된다고 볼 수 있다.
결국 1, 2 단계는 Limiting Step이 된다. 회분흡착에서는 교반에 의한 강제력이 작용하므로 피흡착물이 난류, 확산에 의하여 큰 이동속도를 가지며 초기과정의 Limiting Sep은 피흡착물 및 흡착제의 종류와 분자의 이동속도에 의한 확산 정도에 따라 변화하며 흡착과정의 모형을 아래 그림에 나타낸다.
⑤ 흡착의 종류
| 구분 |
물리적 흡착 |
화학적 흡착 |
| 결합 |
Vander Walls 인력에 의한 약한결합 |
자유전자의 재배열에 의한 강한 이온결합 또는 공유결합 |
| 온도 |
온도가 높을수록 흡착량 감소 |
온도상승에 따라 흡착량이 증가하다 감소 |
| 피흡착질 |
임계온도 이하의 모든 기체를 흡착하는 비선택적(다중흡착) |
화학반응성이 있는 피흡착질만 선택성 흡착(단일흡착) |
| 흡착열 |
적음. 응축열과 같음 (10Kcal/Mole 이하) |
크다. 반응열과 같음 (10~30Kcal/Mole) |
| 흡착속도 |
빠름(Activation이 존재하지 않음) |
느림(활성화 에너지가 필요) |
| 가역성 |
항상 가역적(약 150℃에서도 탈착 용이) |
가역 또는 비가역(800℃ 이상에서 탈착용 용이) |


